hth全站最新登录 分类>>
现如今,随着降糖药物的升级,2 型糖尿病(T2DM)在治疗过程中所追求的目标也慢慢变得高,单独的血糖控制已无法完全满足临床治疗需求,人们逐渐将血糖管理目标锁定在了糖尿病逆转上,也就是「T2DM 缓解」。
实现「T2DM 缓解」可使患者减轻心理负担,提升生活品质,延缓病情进展,降低并发症发生风险[1]。实现 「T2DM 缓解」的首要前提是,糖化血红蛋白(HbA1c) 6.5%[1]。2021年我国和美国糖尿病协会相继发布「T2DM 缓解」相关共识[1],「T2DM 缓解」也因此成为学术界关注的热点话题。
《缓解 2 型糖尿病中国专家共识》指出,「T2DM 缓解」的机制包括三个方面,即纠正胰岛 β 细胞去分化、纠正胰岛素抵抗和纠正肥胖、脂肪肝和脂肪胰。然而,当前大多数降糖药能够达成对血糖的稳定控制已是幸事,想要实现「糖尿病缓解」还真有点「心有余而力不足」。
不过,一款新型降糖药的出现——GIP/GLP-1 单分子双受体激动剂替尔泊(bó)肽(Tirzepatide),正在打破这一糖尿病治疗壁垒,同时针对上述三大机制重拳出击,且往下看!
有研究发现,β 细胞去分化可能是导致 β 细胞数量下降及功能障碍的核心机制[2]。
而导致胰岛 β 细胞去分化的原因多种多样,其中高糖毒性是重要原因之一[1]。纠正高糖毒性可使去分化的 β 细胞再分化为成熟的 β 细胞,恢复胰岛素分泌能力,进而实现「T2DM 缓解」[1]。
GLP-1 和 GIP 是体内的两种肠促胰素,在胰腺最主要的生物学效应发生在 β 细胞,表现为促进胰岛素分泌作用,但在糖尿病个体中,肠促胰素效应受损,刺激胰岛素分泌的比例也随之降至 20%~35%[3]。作为双受体激动剂,的替尔泊肽可选择性地结合并激活 GLP-1 受体(GLP-1R)和 GIP 受体(GIPR),以葡萄糖依赖性地增强第一和第二时相胰岛素分泌,增加胰岛素敏感性,降低胰高血糖素水平[4],更好地发挥肠促胰素效应,纠正高糖毒性。
同时,GIP 和 GLP-1 可共同促进胰岛 β 细胞增殖并抑制其凋亡,从而扩大 β 细胞的量[5]。有研究发现,激活 GLP-1R 和 GIPR 可显著改善 β 细胞功能[6-7]。在另一项研究中,替尔泊肽改善 β 细胞功能的作用也被证实,Melissa K. Thomas 等人的研究表明[8],与安慰剂相比,替尔泊肽 5 mg、10 mg 和 15 mg 治疗 26 周,明显地增加 T2DM 患者胰岛 β 细胞功能的稳态模型评估指数(HOMA2-B)(P 0.001);与度拉糖肽 1.5 mg 相比,替尔泊肽 10 mg 和 15 mg 也明显地增加其 HOMA2-B(P ≤ 0.004)。
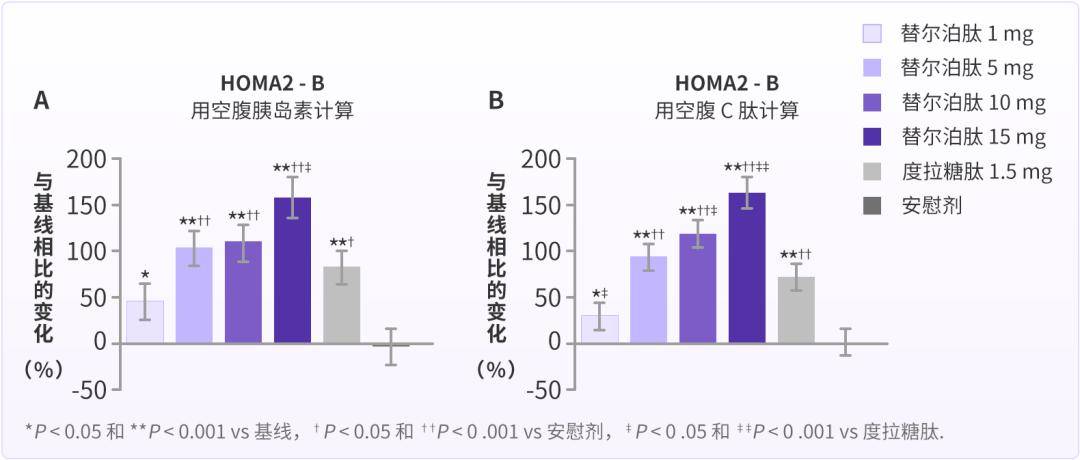
一项多中心、随机、双言、平行组、1 期研究也表明[9],对于早期 T2DM 患者二甲双联合或不联合另一种口服降糖药物医治的 T2DM 患者,替尔泊肽 15 mg 治疗 28 周,较安慰剂和司美格鲁肽 1 mg 显著改善第一和第二时相胰岛素分泌(图 2)。
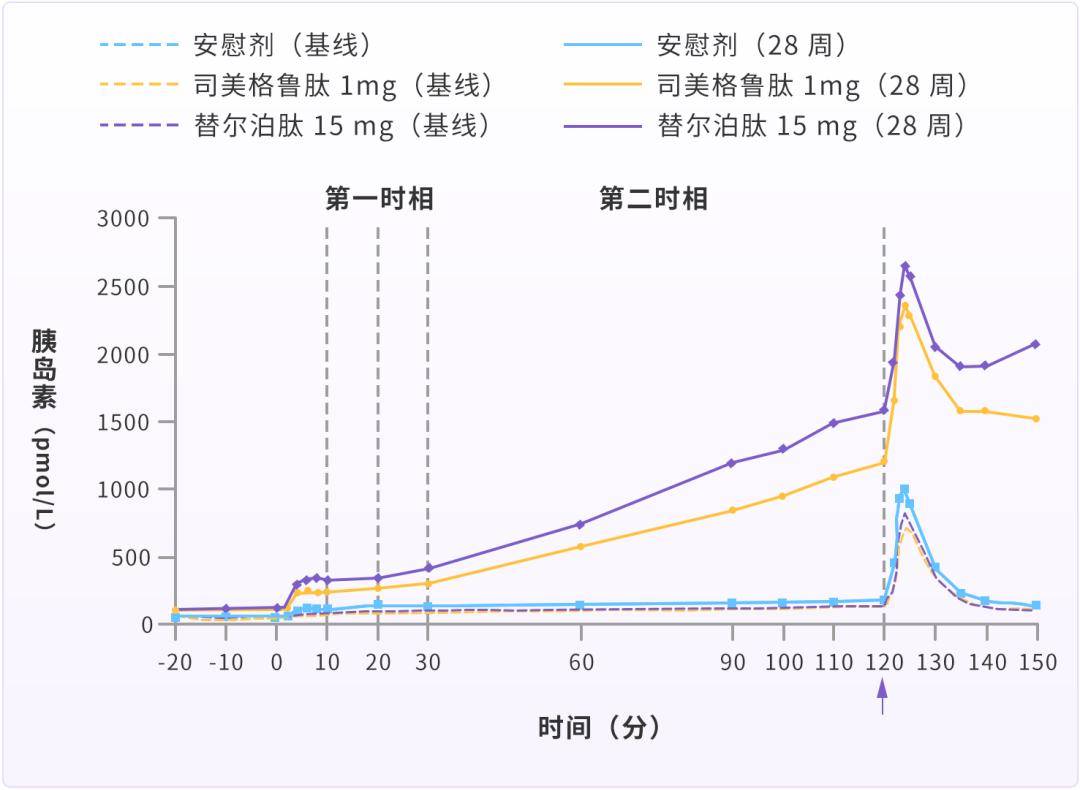
替尔泊肽通过纠正高糖毒性和对胰岛 β 细胞的直接保护作用,为实现「T2DM 缓解」奠定了基础。
胰岛素抵抗是指在稳态条件下,机体对相应浓度胰岛素的生物学反应低于正常水平,即不能像正常个体一样处理葡萄糖,包括肌肉、脂肪及肝脏摄取葡萄糖的能力变弱和肝脏的葡萄糖输出能力增加[10]。所以,改善胰岛素抵抗也成为 「T2DM 缓解」的重要机制和方法之一[1]。
在肥胖小鼠的研究中,替尔泊肽对胰岛素敏感性的改善,仅 30% 通过体重依赖作用。经过 14 天的治疗,替尔泊肽组与司美格鲁肽组、配对喂养组小鼠的体重和食物摄入量无显著差异,但高糖钳夹试验中替尔泊肽组的葡萄糖输注率(GIR)明显高于司美格鲁肽组和配对喂养组,提示替尔泊肽组存在非体重依赖的胰岛素敏感性改善[11]。
在人体试验中,替尔泊肽改善 T2DM 患者的胰岛素抵抗、增加胰岛素敏感性也同样被证实。研究表明[8],与安慰剂和度拉糖肽 1.5 mg 相比,经替尔泊肽 10 mg 和 15 mg 治疗 26 周明显降低 T2DM 患者空腹胰岛素水平(P ≤ 0.033),替尔泊肽 10 mg 明显降低胰岛素抵抗的稳态模型评估指数(HOMA2-IR)(P = 0.004)。此外,改善胰岛素敏感性的标志物总脂联素、结合蛋白-1 和结合蛋白-2 也明显地增加(P 0.05)。
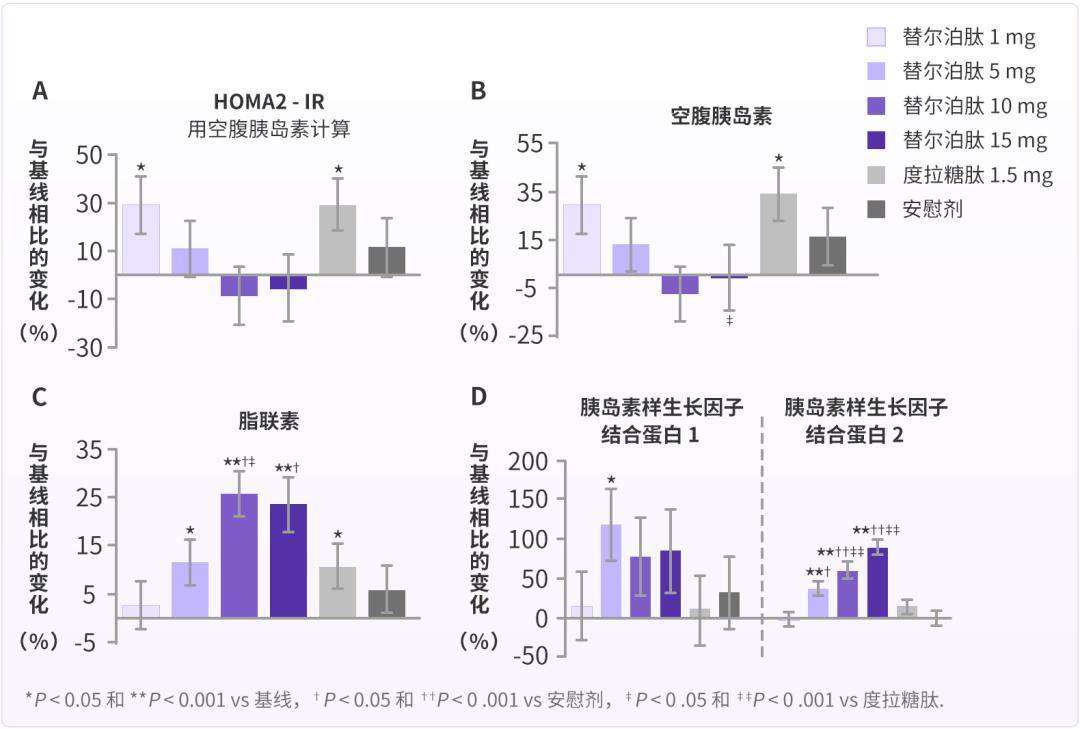
另外,在 Ⅰ 期临床试验中,替尔泊肽 15 mg 治疗 28 周可显著改善 T2DM 患者的钳夹处置指数,优于司美格鲁肽 1 mg 和安慰剂,提示替尔泊肽有效改善胰岛素分泌功能和胰岛素敏感性[9]。
肥胖、脂肪性肝病、脂肪胰同流合污,对胰岛 β 细胞功能造成不好影响[1]。对此,《缓解 2 型糖尿病中国专家共识》将减重作为缓解超重或肥胖 T2DM 的核心[1]。
在减重方面,替尔泊肽也有「高招」,其通过同时激活 GLP‐1R 与 GIPR,线 的效果。激动 GLP‐1R 可抑制胃排空及抑制食欲,从而发挥减重作用[10]。而 GIPR 除了改善异位脂肪沉积带来的减重获益,还在下丘脑中表达,参与中枢能量调节,并发挥降低食欲、减轻体重的作用[12]。
人们常说「没有目标,就没有方向」,实现「T2DM 缓解」同样如此,不仅要「减重」,更要「有目标的减重」。《ADA/EASD:2 型糖尿病高血糖管理共识(2022)》[13]指出,体重降低 5%~10% 可改善代谢状况,降低 10%~15% 或以上可改善疾病,实现「T2DM 缓解」。
替尔泊肽的 SURPASS 系列研究表明[14-18],无论是单药治疗,还是联合口服降糖药(二甲双胍、SGLT2i)或基础胰岛素,均较安慰剂或活性对照药物(基础胰岛素、GLP-1RA)明显降低体重。
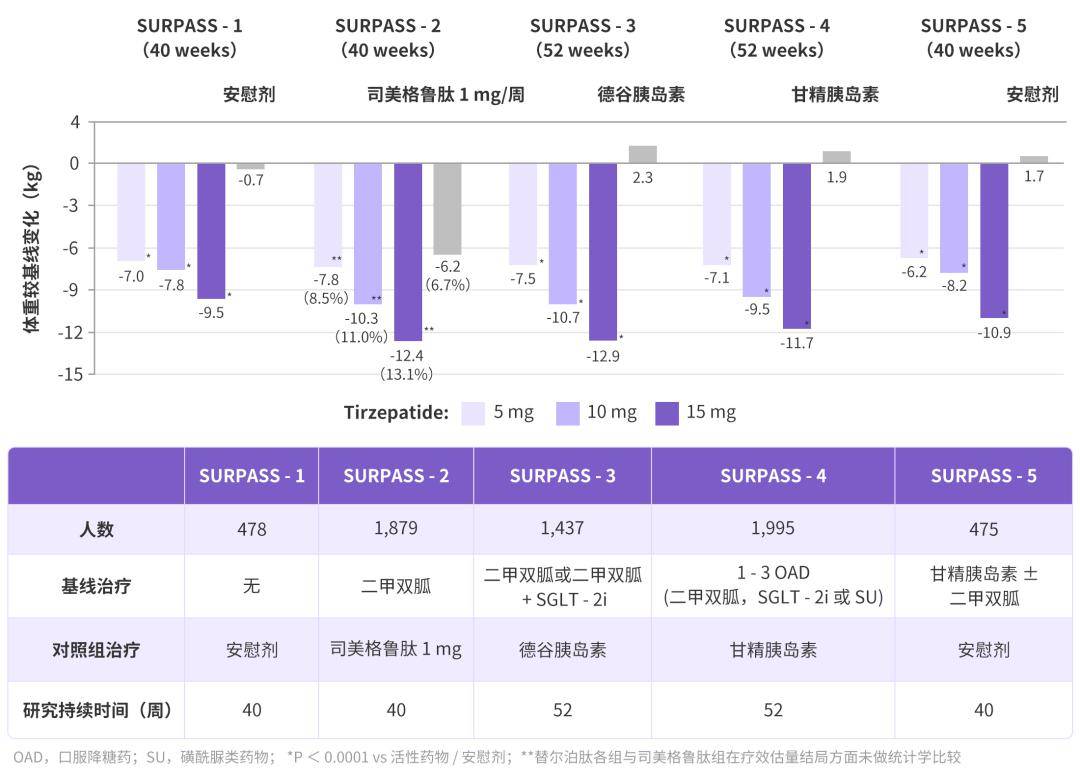
从上述表格能看出,在 SURPASS-2 研究中[15],替尔泊肽减重表现突出,与基线 mg 已显著优于司美格鲁肽。
需指出的是,T2DM 患者减重不仅是控制体重和 BMI 本身,更重要的是减少体内过量的脂肪沉积[19]。替尔泊肽在有效减重的同时,对内脏脂肪有何影响呢?SURPASS-3 MRI 子研究[20]纳入 296 例服用二甲双胍(联合或不联合 SGLT-2i)的 T2DM 患者,随机给予替尔泊肽 5 mg(n = 71)、替尔泊肽 10 mg(n = 79)、替尔泊肽 15 mg(n = 72)或德谷胰岛素(n = 74)治疗。主要终点为基线 mg 两个剂量组合并数据)与德谷胰岛素组肝脏脂肪含量(LFC)的变化。研究表明,治疗 52 周,与基线 mg 组 LFC 的相对降幅分别为 29.78%(p 0.0001)、47.11%(p 0.0001)和 39.59%(p 0.0001),且 LFC 的降低与基线 LFC、内脏脂肪体积(VAT)的减少、腹部皮下脂肪(ASAT)的减少及体重的降低显著相关。实现「T2DM 缓解」糖化血红蛋白(
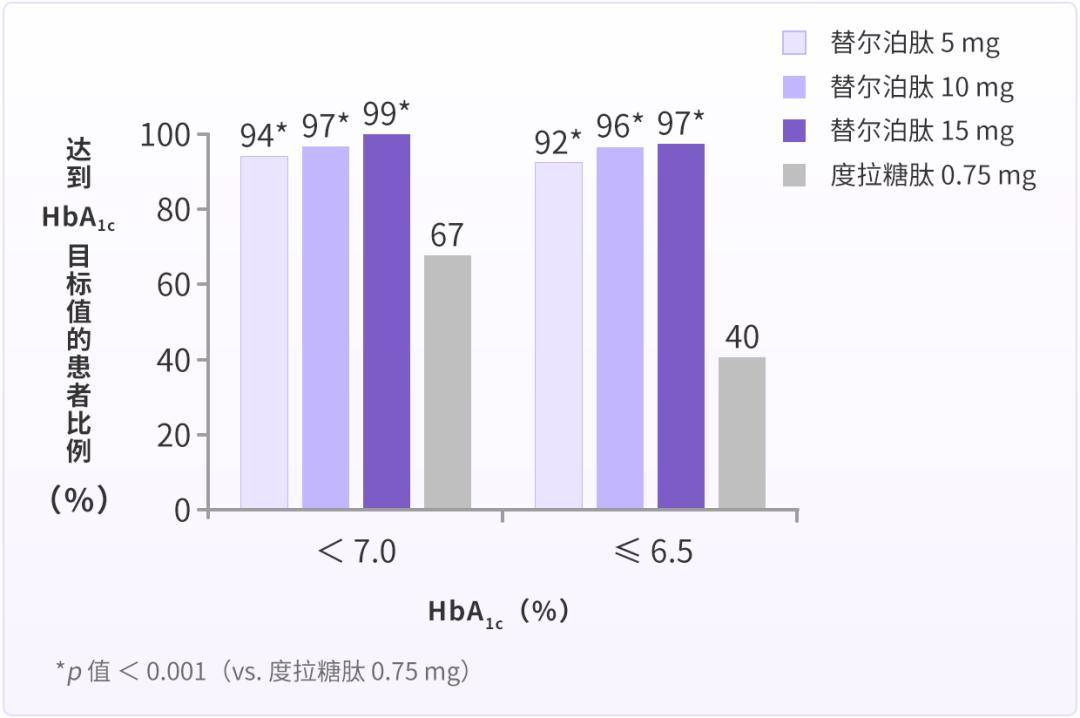
实现「T2DM 缓解」可使患者减轻心理负担,提升生活品质,延缓病情进展,降低并发症发生风险。替尔泊肽通过激动 GIPR 与 GLP-1R,针对「T2DM 缓解」的三个机制,重拳出击,为实现「T2DM 缓解」带来希望。相信未来该药在国内获批上市后,会为 T2DM 患者带来更多获益。





 2024-03-02 03:46:58
2024-03-02 03:46:58  作者:
作者:  返回列表
返回列表 友情链接:
友情链接:






